
微信里点“发现”,扫一下
二维码便可将本文分享至朋友圈。
11月15日,上海阳光医药采购网发布《4+7城市药品集中采购文件》。国家组织药品集中采购试点,试点地区范围为北京、天津、上海、重庆和沈阳、大连、厦门、广州、深圳、成都、西安11个城市(简称“4+7城市”)。
文件提出,根据已批准通过国家药品监督管理局仿制药质量和疗效一致性评价目录和按《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》〔2016年第51号〕化学药品新注册分类批准的仿制药品目录,经联采办会议通过以及咨询专家,确定31个采购品种(指定规格)及约定采购量。
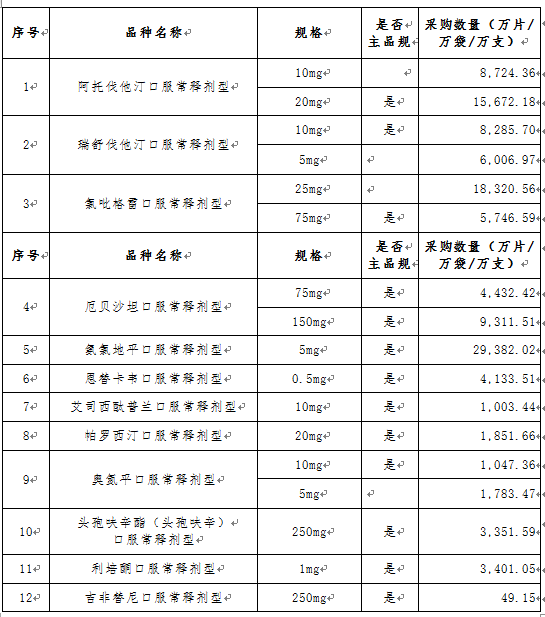
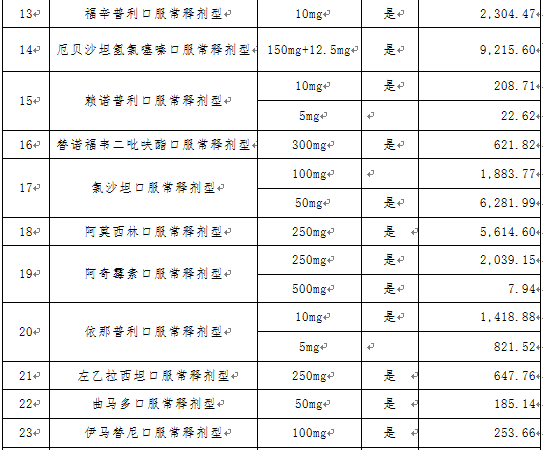
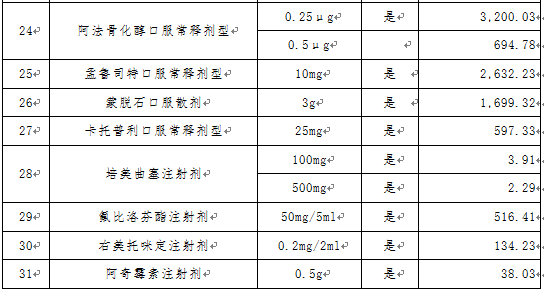
文件进一步明确了申报企业资格,申报企业是指提供药品及伴随服务的国内药品生产企业,进口药品国内总代理商视同生产企业。申报企业承诺申报品种的全年产销能力达到本次采购数量要求。
同时文件规定,申报品种属于采购品种目录范围,且需要满足以下要求之一:原研药及国家药品监督管理局发布的仿制药质量和疗效一致性评价参比制剂;通过国家药品监督管理局仿制药质量和疗效一致性评价的仿制药品。根据《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》〔2016年第51号〕,按化学药品新注册分类批准的仿制药品。






关注中国财富公众号