
微信里点“发现”,扫一下
二维码便可将本文分享至朋友圈。
上周五,国家医保局药品集中采购试点座谈会在北京召开,北京、上海、天津、重庆、辽宁、广东、福建、四川、陕西等多省市药品招标采购行政部门参会。会议的重点是,讨论如何以通过一致性评价的仿制药替代原研药,从而推动药价的下降。根据相应规定,如果国家医保局的政策落地,意味着全国70%的市场份额将由3家通过一致性评价的本土药企分享,通过一致性评价的药企将迎来重大利好,而未能通过一致性评价的企业或被淘汰出局。
一致性评价药品将为集中采购突破口
国家医保局会议围绕通过一致性评价药品带量采购展开。主要内容有:一是针对已通过一致性评价的产品,试点城市重新进行采购;二是已通过一致性评价的产品逐步替换原研药市场;三是讨论了用各省70%的市场份额交换通过一致性评价产品以及原研产品的最低报价,并以此产品的最低报价作为医保的支付价是否可行听取各代表省份意见。座谈会透露了国家医保局组织下的药品采购试点基本思路,国家组织的药品集中采购工作将以通过一致性评价药品为突破口。
如此,通过一致性评价的药品迎来的不仅是及时挂网,还可能是医疗机构及时的采购。未来,各医疗机构将根据原研药、通过一致性评价仿制药、未过一致性评价仿制药的现实情况,重新安排采购工作。目前,相对于价格高、处于有利竞争位置的原研药,仿制药的市场空间非常有限,集招标采购、支付、定价于一体的超级医保局来推动仿制药替代,未来将是通过一致性评价的3个仿制药与1个原研药之间的竞争,相对低价的通过一致性评价药的市场空间将打开。对于用各省70%的市场份额交换通过一致性评价产品以及原研产品给出的最低报价作为医保支付,如果真正实施,只要通过一致性评价仿制药出价合理,即可以做到以价来换取全国的量。国务院文件规定,同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。也就是说,3家通过一致性评价的本土药将企分享70%的市场份额,带来的是销量快速提升。
我们来看一个例子。2017年,苯磺酸氨氯地平片在国内的销售额约16.9亿元,原研辉瑞占了86.93%的市场份额,7月底通过一致性评价的华润双鹤子公司华润赛科的仿制药占4.59%份额。如果国家医保局的政策落地,华润赛科的销售显然能大幅上升。
仿制药一致性评价总体格局
总的来看,仿制药一致性评价的范围包括四个方面:“289”基本版、按照新4类仿制药标准申报的品种、一致性评价注射液、生物类似药。
2016年5月26日,原国家药监总局发布公告:“凡2007年10月1日前批准上市的列入国家基本药物目录(2012年版)的化学药品仿制药口服固体制剂,原则上应在2018年底前完成一致性评价”。289个基药品种是一致性评价的基本版。截至2018年7月31日,这个基本版中通过一致性评价的品种有13个,有36个品种正在申请一致性评价,仍有近200个品种处于无BE临床试验登记、无一致性评价申请、无通过一致性评价的“三无状态”。但也有品种竞争相当激烈,如他达拉非片,目前在审仿制申请有23个,涉及11家企业。截至8月1日,有40多个通过一致性评价的受理号是非“289”基本版品种。这些品种大多是按照新4类仿制药标准申报的,有的是以同一生产线生产、已在国外上市等名义申报的。
2017年12月22日,原国家药监总局发布《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》;7月6日,全国药品监管工作座谈会上提出启动药品注射剂再评价工作。目前,有10多个注射剂申报了一致性评价,销售规模均较大,如盐酸氨溴索注射液,2017年销售额达65亿元。
生物类似药即生物制剂仿制药,耳熟能详的单抗即属于这个范畴。如果说“289”基本版是常规药品,生物类似药即是仿制药中的高端版。据行业数据,生物类似药的研发需要8-10年甚至更长时间,需投入2.5亿美元(中国大约在2-4亿人民币)。只有小部分本土药企具备这项技术能力和资金实力。目前,依那西普单抗已有仿制药上市,利妥昔单抗、阿达木单抗、英夫利单抗、曲妥珠单抗、贝伐珠单抗等5个单抗仿制药正在上市和临床审评中,这5个单抗去年全球销售额均超过70亿美元。
梯队差异带来受益差距大
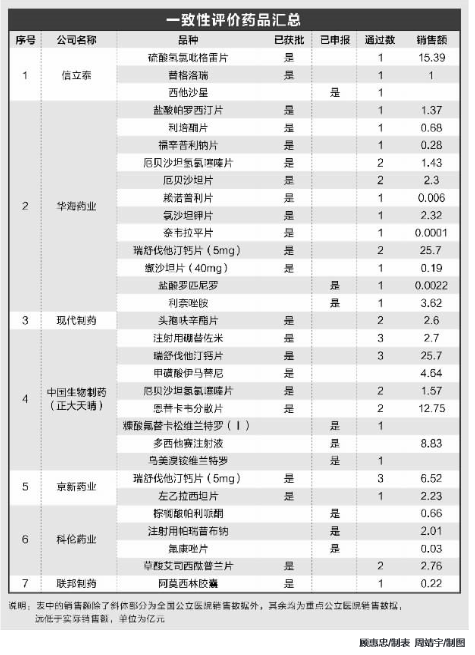
据不完全统计,截至上周末,大约有19家上市公司有一致性评价仿制药获批或在审评中。这些公司中,有一致性评价工作准备较早的华海药业,有申报品种不多但通过的单一品种过百亿的信立泰,有一般仿制药和生物类似药都有布局的复星医药,有7月底才拿到第一个一致性评价批文的恒瑞医药,有后来居上、最近申报品种较多的科伦药业。如果我们按申报或获批数量、申报品种技术含量等指标去看,上市公司一致性评价团队大概可以划分为三个层次。
第一梯队,申报和获批数量多,且高端仿制药占比高的上市公司,主要有中国生物制药、复星医药、石药集团、恒瑞医药等4家。其中,中国生物制药目前有注射用硼替佐米、瑞舒伐他汀钙片、甲磺酸伊马替尼、厄贝沙坦氢氯噻嗪片、恩替卡韦分散片等5个品种通过了一致性评价,其中,注射用硼替佐米是治疗多发性骨髓瘤的一线用药,2017年销售额在27亿元左右,中国生物制药其余4个药的销售均超过15亿元;还有糠酸氟替卡松维兰特罗、多西他赛注射液、乌美溴铵维兰特罗等3个仿制药已申报了一致性评价。
第二梯队,申报和获批数量多,且多为常规药品,或申报和获批数量不多,但单一品种销售额大的上市公司,以华海药业和科伦药业为代表,东阳光药7月份开始发力。其中,华海药业已有盐酸帕罗西汀片、利培酮片、福辛普利钠片、厄贝沙坦氢氯噻嗪片、厄贝沙坦片、赖诺普利片、氯沙坦钾片、奈韦拉平片、瑞舒伐他汀钙片、缬沙坦片等10个品种通过一致性评价,为通过一致性评价最多的药企,其中,瑞舒伐他汀钙片2017年销售额为25.7亿元;此外,还有盐酸罗匹尼罗、利奈唑胺两个品种在审评中。东阳光药最近发力,除了厄贝沙坦片通过一致性评价外,有莫西沙星片、奥氯平、利格列汀、利格列汀二甲双胍片、他达拉非等5个申报在审评中。海正药业及其子公司有瑞舒伐他汀钙片、利奈唑胺、依那西普等3个品种通过一致性评价,硫酸氨基酸葡萄糖胶囊在审评中。
第三梯队,申报和获批数量较少的上市公司。这个梯队的公司较多,京新药业有重磅品种瑞舒伐他汀钙片和左乙拉西坦片两个品种通过了一致性评价;上海医药子公司有卡托普利片1个品种通过了一致性评价,有盐酸二甲双胍片、布洛芬缓释胶囊2个品种在审评中;九典制药有盐酸左西普利嗪片1个品种通过了一致性评价,还有酮洛芬1个品种在审评中;有4家上市公司各有1个品种通过一致性评价,分别是现代制药控股子公司的头孢呋辛酯片、联邦制药的阿莫西林胶囊、普利制药的注射用阿奇霉素、华润双鹤的苯磺酸氨氯地平片;有3家公司各有1个品种在审评中,分别是海思科的氟哌噻吨美利曲辛片、双鹭药业的替莫唑胺、华东医药的右旋兰索拉唑。
除了上市公司,还有一些公司申报的一致性评价中不乏大品种,如盐酸氨溴索注射液,2017年销售额为65亿元。
从三个梯队的情况来看,各家公司受益的差异性较大。
最近,医疗反腐动作颇多。医疗行业一些人士在反思时说,一个品种的药有几十个号,同药多名、同药多价,同质竞争,这是滋生腐败的温床,也是导致回扣的根源。以2017年全国销售额仅为1.19亿元的异烟肼片为例,居然有383家生产企业、571个药品批文。国家医保局新政也将起到治理仿制药重复建设、重复申请、恶性竞争的作用。
(研究员 顾惠忠)